近日,为应对疫情爆发期间的个人防护用品以及医疗器械的短缺问题,美国发布EUA(应急使用授权),前提是要确保产品达到足够的健康和安全水平。
目前已经列入EUA的包括(新冠检测试剂、口罩、呼吸机设备等),EUA名录持续更新中。
美国医疗器械是由食品药品监督管理局(FDA)管理批准上市。
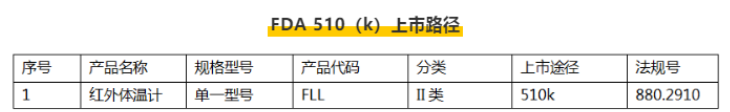
医用口罩、电子体温计、红外体温计(额温枪)都属于Ⅱ类医疗器械,需要按FDA510_(k)方式申请。
EUA只是加快了产品审核流程
在体温计还没有被列入EUA的当下
讯科商品检验建议:
无论EUA名录如何变动,产品都以合规为前提,体温计生产商应提前启动FDA合规准备工作(产品检测+FDA510(k)文件准备),一旦应急上市途径明确,在产品合规的前提下,产品通过FDA EUA)应急审批即可出货清关。
讯科商品检验能提供
体温计FDA\CE等加急检测服务欢迎咨询!
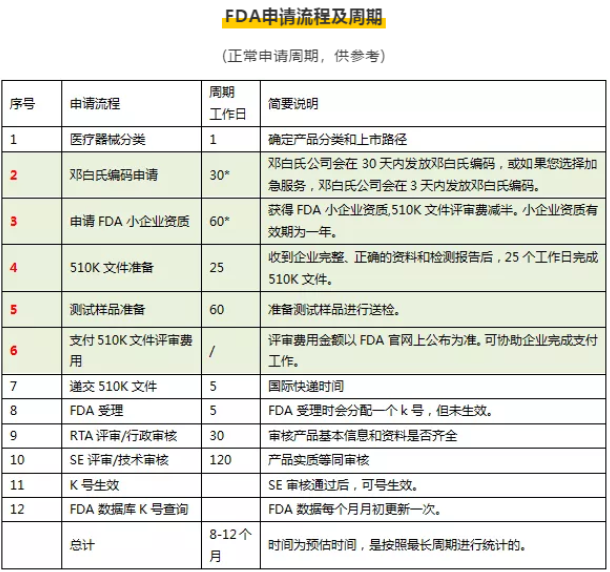
FDA510(k)申请流程
1.FDA510(k)文件准备2.产品检测---510(k)递交申请
3.FDA根据产品类型提交需要注册的资料清单
4.企业按要求递交相关资料
5.FDA对其进行审批
6.企业根据要求进行整改
7.FDA最终做出决定
8.获得批准k号生效
根据FDA官方的规定,适用的产品代码如下:
1.外科口罩(FXX)
2、带有抗菌剂抗病毒剂的外科口罩(OUK)
3、儿科儿童口罩(OXZ)
4、手术服(FYA)
5、隔离服和或者配件(FYC,LYU,OEA))
6、外科服(FXO)
7、体温计(FLL)
例:额温枪FDA510(k)上市路径
上一篇:医疗器械CE认证流程是什么?
下一篇:NIOSH认证暂时被EUA(紧急使用授权)认证替代,KN95口罩EUA紧急使用授权
- NCCS宣布光网络终端和光线路终端安全认证的强制日期
- 国家认监委批准《汽车芯片认证审查 通用技术要求》等5项认证认可行业标准
- 欧盟扩大REACH附录XVII 多环芳烃(PAHs)的限制 范围!
- 欧盟发布化学和相关活动的实验装置标准EN 71-4:2020+A1:2025
- 加拿大ISED认证收费标准调整要注意什么
- ECHA发布REACH PFAS限制提案最新进展
- 国家卫生健康委发布5项食品接触材料新标准及1项标准修改单
- 服装及鞋袜国际RSL管理(AFIRM)2025版限用物质清单测试介绍
- 双标”+监督办法三重升级!2025食品标签新规亮点解析
- 美国加利福尼亚州:乙酸乙烯酯被列入加州第65号提案致癌物质清单



